Website voor fenomenologie van de natuur
Antimoon of Stibium - Gerard Smits (2020)
Er zijn zo`n 100 soorten mineralen van Stibium bekend, maar het meest voorkomende is het stibniet of antimoniet Sb2S3, een antimoon zwavelverbinding, antimoontrisulfide. In de diepte der aarde zijn de meeste metalen ook met zwavel verbonden. Vaak komt het Sb2S3 voor als radiaal stralende zwartgekleurde naalden een soort stralenbundel vanuit een centrum uitgaand. Soms zoals in Japan kunnen deze naalden of strengen meer dan een meter lang zijn. Smelt je het antimoonsulfide bij 550 0C onder afsluiting van de lucht en laat je het stollen, dan zie je naalden of stralen ontstaan van periferie naar een centrum toegaand. Er zijn ook gemengde sulfidische ertsen met kwik Hg(Italië en Rusland) , met zilver Ag, koper Cu en lood Pb in Amerika.
Toepassingen:
60% van het antimoon in de vorm van zijn oxiden of sulfaten wordt gebruikt als brandvertragers bij bekleding van autostoelen, kinderkleding en speelgoed, zodat deze meer brandwerend worden. Legeringen van antimoon met een ander metaal maakt het metaal harder en meer gevormd. Ongeveer 20% van het antimoon wordt verwerkt als loodlegering als loodplaten in accu`s, soldeer, kogellagers, kielen van (zeil)boten. In oude drukletters werd de legering lood met antimoon (3 : 1) gebruikt. Behalve dat het lood harder werd en zo beter de drukpers kon weerstaan, kreeg je goed vastgezette drukletters in de matrijzen, omdat de antimoonlegering uitzet bij afkoelen en zo de matrijs in zijn geheel kon vullen.
Een legering van tin met antimoon wordt gebruikt om orgelpijpen te maken. Ook hier wordt het zachte tin wat verhard. Antimoon wordt gebruikt als katalysator bij het vervaardigen van de kunststof PET. Antimoon wordt ook gebruikt in de halfgeleider industrie bij diodes en transistors. Samen met het metaal indium zit het in infrarood sensoren. Om luchtbelletjes uit glas te verwijderen, wordt antimoon toegevoegd aan gesmolten glas. Ook wordt ervan antimoon nog een verf gemaakt; het Napels geel. Dan zijn er nog talrijke medicinale toepassingen al dan niet homeopathisch.
Het gebaar van antimoon:
Qua chemie heeft dit metaal overeenkomsten met koper, kwik en zilver, qua kristalstructuur met tin, maar verder heeft antimoon weinig eigenschappen met de meeste metalen gemeen. Het wordt dan ook een metalloïde genoemd. Hij staat tussen de metalen en de niet-metalen in. Het metaalachtige is niet volkomen ontwikkeld. Pelikan noemt het een soort zwavel met metaaleigenschappen.
Zijn gedrag ten aanzien van de “Unternatur” elektriciteit en magnetisme is alsof hij zich daartegen weert. Het uitzetten als het vloeibare overgaat in de vaste vorm ;overeenkomend met water. Hierbij wordt de vaste stof lichter dan de vloeistof. Al deze fenomenen wijzen erop dat het antimoon zich van het aardse zware af wil keren.
Dan de vormkrachten, die al te zien zijn in zijn erts het stibniet met zijn stralende strengen. Maar ook het metaal beschikt over kristalvormen en zoals wij gezien hebben bij de toepassingen van de legeringen brengt het door zijn hardheid meer vorm en structuur aan. Als wij de kwaliteiten van het etherische(licht, warmte, kristallisatie-, chemische- en perifere krachten, die van de omgeving naar een centrum toewerken) naast die zetten van het aardse(zwaartekracht, druk, elektriciteit, magnetisme, centrale krachten(van een centrum naar de omgeving werkend), dan kunnen wij zeggen dat het antimoon zich open stelt voor de etherische perifere krachten om die met het aardse te verbinden.
LEES VERDER IN ONDERSTAANDE DOWNLOAD!
SmitsANTIMOON of STIBIUM2020
Gerard Smits - november 2020 - Eigenschappen, toepassingen en karakterisering van Stibium of Antimoon (4 pag.).
HIER TE DOWNLOADEN!
Zouten, zuren en basen - Antoon van Hooft (mei 2017)
het verhitten van kopersulfaat.
In het algemeen wordt in de scheikunde onderscheid gemaakt tussen de anorganische en organische (koolstof)chemie. De oorzaak van de reactie wordt dan gelegd bij ladingsverschillen en energieverschillen (enthalpie en entropie).
Hierbij wordt over het hoofd gezien dat de oorzaak van de reacties in minerale wereld verschilt van die in planten, dieren en mensen. Bij minerale chemie moet de oorzaak van de reacties in de stof zelf gezocht worden. Daarnaast onderscheiden we plantenchemie, dierenchemie en mensenchemie, waarbij de oorzaak van de stofwisseling respectievelijk ligt het organiserende principe van de plant, het dier en de mens.
Wij gaan ons nu bezighouden met een onderdeel uit de minerale chemie; zouten, zuren en basen. Het woord ‘mineraal’ is afkomstig van ‘mine’ wat mijn betekent, wat weer samenhangt met mijnbouw. Het gaat dus om stoffen die afkomstig zijn uit de aardkorst, zoals bijvoorbeeld stenen en zouten, maar ook water en lucht uit de atmosfeer behoren hiertoe. Zij zijn zelf niet levend en vormen de basis van de levende natuur.
Zouten
We starten met een practicum waarbij we verschillende zouten zullen verhitten.
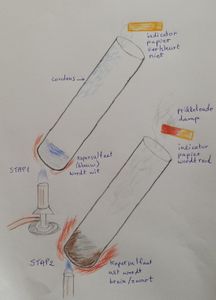
Proef 1 verhitten van kopersulfaat.
Stap 1: In een reageerbuis verhitten we het blauwe kopersulfaat. Vrij snel zien we dat de blauwe stof verandert in een witte stof. Aan de binnenkant van de buis condenseert een heldere vloeistof, soms ontsnappen dampen die het gele indicatorpapier niet doen verkleuren. Door het toevoegen van een paar druppels water aan het witte poeder wordt het weer blauw.
Stap 2: We beginnen de proef opnieuw. We laten stap 1 verlopen. Daarna blijven we verhitten met een felle vlam. De witte stof verkleurt in een bruine, soms in een zwarte stof. De dampen die vrijkomen prikkelen de keel en kleuren het indicatorpapier rood.
De bruin/zwarte stof lost niet op in water, het reageert wel met zwavelzuur.
Reactie stap 1
blauw kopersulfaat -> wit kopersulfaat + kristalwater
transparant kristal verhitten wit poeder
Reactie stap 2
wit kopersulfaat -> bruin/zwart koperas + zwavelzure damp
verhitten
Bespreking proef 1
Het gebaar bij stap 1 is dat het blauwe zout uiteenvalt in waterdamp (licht) en een vaste, aardeachtige stof (zwaar). We zien dat het water (zie verderop voor karakterisering) het vermogen heeft kleur en transparantie te doen ontstaan. Daarnaast maakt water het mogelijk dat de kristaltoestand (kristallos = ijs) kan terugkomen.
Bij stap 2
Hier zien we een uiteengaande in tegengestelden. Een zure, prikkelende damp stijgt op, terwijl een zware, zwarte stof, achterblijft. De zwarte stof heeft geen affiniteit met water.
De zwarte as is koperoxide. Het is zwaar en passief en vertoont basische eigenschappen. Hier tegenover staat het zure zwavelzuur dat prikkelend, wakker maken en actief is.
De basische eigenschap van de zwarte as wordt duidelijk uit zijn reactie met zwavelzuur (zuur-base reactie); bij deze reactie vormt zich weer het blauwe zout kopersulfaat.
Proef 2 verhitten van ijzersulfaat.
Stap 1: In een reageerbuis verhitten we het turquoise ijzersulfaat. Sneller als bij kopersulfaat zien we dat de stof veranderd in een witgrauwe stof. Aan de binnenkant van de buis condenseert weer water; meer dan bij kopersulfaat. Door het toevoegen van een paar druppels water aan het witgrauwe poeder wordt het weer turquoise.
Stap 2: We beginnen de proef opnieuw. We laten stap 1 verlopen. Daarna blijven we verhitten met een felle vlam. De witte stof verkleurt in een bruinrode stof. De kleurverandering gebeurt sneller dan bij kopersulfaat. De dampen die vrijkomen prikkelen de keel en kleuren het indicatorpapier rood.
Reactie stap 1
turquoise ijzersulfaat -> wit ijzersulfaat + kristalwater
transparant kristal verhitten wit poeder
Reactie stap 2
wit ijzersulfaat -> bruinrode ijzeras + zwavelzure damp
verhitten
Bespreking proef 2
Bij proef 2 verlopen vergelijkbare processen als bij proef 1. Er is meer kristalwater nodig om te ‘verijzen’, te kristalliseren als bij kopersulfaat. IJzersulfaat is makkelijker op te splitsen dan kopersulfaat. Als zout is het dus minder stabiel dan kopersulfaat.
Als we de assen (oxiden) van koper en ijzer op papier uitsmeren wordt duidelijk dat beide stoffen door kunstschilders als kleurstof gebruikt kunnen worden. In de praktijk worden de stoffen vermengd met een olie.
Proef 3 verhitten van keukenzout.
In een reageerbuis verhitten we het witte keukenzout (= natriumchloride). In het begin horen we een enigszins knetterend geluid terwijl een waas van condens aan de binnenkant van de buis ontstaat. Na ca. 5 minuten fel verhitten wordt de witte stof onderin doorzichtig en al snel merken we dat er een heldere vloeistof is ontstaan. Het keukenzout is gesmolten! Als we de buis uit de vlam halen en hem in rust laten afkoelen zien we de vloeistof wazig worden en al snel is er een witte, vaste stof ontstaan.
Als we de buis stukslaan kunnen we in de brokstukken van de witte stof kubusvormige keukenzout kristallen ontwaren.
Bespreking proef 3
Het keukenzout heeft geen kristalwater. De condens is afkomstig van water dat het zout uit de lucht aantrekt. Keukenzout is hygroscopisch (wateraantrekkend). Het heeft geen water nodig om te ‘ver-ijzen’. Het kristalliseert op ‘eigen kracht’. Het blijkt een uiterst stabiele stof te zijn. Door deze stof te verwarmen kunnen we hem smelten (801oC), zelfs laten koken (1465oC), maar splitsen zoals bij de hierboven besproken zouten lukt niet.
Proef 4 proef met rode en blauwe ballon.
Een ballon (rood) met waterstof en een ballon (blauw) met zuurstof worden losgelaten. De blauwe ballon valt omlaag, de rode ballon stijgt op.
Bespreking proef 4
De rode ballon met waterstof is zeer licht en stijgt op. De blauwe ballon met zuurstofgas is relatief zwaar en valt naar de grond. De dichtheid van waterstofgas blijkt 0,090g/L te zijn, die van zuurstof gas 1,43 g/L en die van droge lucht 1,29 g/L, steeds bij 0oC.
Proef 5 verhitten rode en blauwe ballon.
Wanneer we de ballonnen met 100% waterstof en 100% zuurstof aan een statief bevestigen en met een lucifer aansteken klapt de blauwe ballon met een ‘gewone’ knal. De rode ballon echter springt open terwijl er een korte tijd een rode vuurbal in de lucht verschijnt. De doffe, zware dreun voelen we in de borstkast. Veel warmte komt vrij.
Bespreking proef 5
Zuurstof hebben we verhit maar blijkt niet te kunnen branden. Zuurstof zelf brandt niet, het doet andere stoffen verbranden.
Waterstof daarentegen is zeer brandbaar. Tijdens de verbranding reageert het met zuurstof en vormt water.
Verbrandingsreactie waterstof:
waterstof (H2) + zuurstof (O2) -> water (H2O) + warmte
gas gas vloeistof
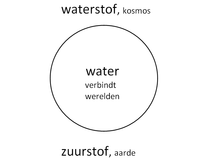
Het aardse zuurstof trekt als het ware het kosmische waterstof omlaag en vormt het vloeibare water. Warmte komt vrij, dat wil zeggen dat er een meer aardse stof (nl. water) ontstaan is. Water is dus een verbinding van aardse en kosmische kwaliteiten.
Karakterisering van waterstof, zuurstof en water
bemiddelend medium ...
Het feit dat een bij uitstek polair fenomeen zoals elektriciteit water splitst in waterstof en zuurstof, laat zien dat de twee gassen polaire elementen zijn. Waterstof kunnen we een kosmisch vuurgas noemen, zuurstof een aards levensgas.
Waterstof is extreem fijn en brandbaar. Het komt in grote hoeveelheden voor in de kosmos. Het maakt deel uit van de zonnewind en de aarde ontvangt van hieruit steeds verse waterstof. Het is een goede reductor en haalt stoffen uit hun geoxideerde toestand.
Zuurstof is zeer aards. Het is verbonden in stenen en water, het komt voor in de atmosfeer en de biosfeer; het ‘trekt’ de stoffen in de aardse toestand. Zo ‘trekt’ het ook waterstof naar de aarde. Beide stoffen reageren met elkaar waarbij water gevormd wordt en veel warmte ontstaat.
zuurstof + waterstof -> water
De omgekeerde reactie, water omzetten in waterstof en zuurstof kan alleen met elektriciteit. Aan de plus-pool verschijnt dan zuurstof en aan de min-pool waterstof.
Water als bemiddelend medium
Water is dus een stof die ontstaan is uit het kosmische waterstof en het aardse zuurstof. Het verbindt dus twee tegengestelde werelden en is open voor invloeden uit beide werelden. Het komt voor in de lithosfeer, in de atmosfeer en in de biosfeer. Samen met koolzuurgas is water nodig bij de fotosynthese. Hierbij levert water de zuurstof die vrijkomt bij het groene blad. Wetenschappers zijn voortdurend op zoek naar water op andere hemellichamen omdat water verbonden wordt met levensprocessen. Water manifesteert zich in verschillende verschijningsvormen; als ijs, als vloeibaar water en als waterdamp. Zonder water zijn geen levensprocessen mogelijk en waarschijnlijk is voor elke chemische reactie een spoortje water noodzakelijk. Om voedsel houdbaar te maken (het leven eruit te halen) wordt het water verwijderd; bijvoorbeeld gedroogde vis en gedroogd vlees.
Water is dynamisch en is een medium waarin zich reacties van verbinden en splitsen afspelen. Water zelf blijft vaak op de achtergrond en neemt de kwaliteit aan van de stof die erin is opgelost. Een beetje zout doet het zout smaken, een beetje suiker doet het zoet smaken. In het oplossen van stoffen (= het opgaan in de volledige ruimte waarvoor warmte vereist is) toont het zijn kosmische karakter. In het neerslaan van stoffen (samentrekking naar een centrum waarbij warmte vrij komt) toont het zijn aardse karakter.
Water is net als keukenzout niet te splitsen met warmte. (Het splitst pas bij extreme verhitting bij enkele duizenden graden, waartegen trouwens geen enkel stof bestand is.)
Water (en ook keukenzout) is wel te splitsen met behulp van elektriciteit.
Metalen en niet-metalen
Koperoxide wordt omgezet in koper.
Bereiden van metalen
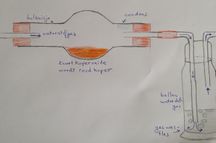
Proef 6 reductie van koperas.
In een bolbuisje wordt zwart koperoxide gedaan. Door de buis wordt puur waterstofgas geleid. Als we het bolletjes verhitten zien we dat de zwarte stof gaat gloeien en dat aan de binnenkant van de buis condens neerslaat. Het blijkt dat uit de zwarte stof het rode koper is ontstaan!
Reductie reactie:
waterstof + koperoxide -> koper + water
H2 CuO Cu H2O
gas vast vast vloeistof
brandbaar onbrandbaar brandbaar onbrandbaar
Het waterstof heeft zijn edelheid opgegeven, koper heeft aan edelheid gewonnen en stijgt op van zijn geoxideerde situatie naar het element niveau. Het gasvormig waterstof is gebonden in het meer aardse, vloeibare water.
Op dezelfde manier kunnen we het metaal ijzer vrijmaken uit het rode ijzeroxide (roest). In de praktijk wordt hiervoor niet het dure waterstof gebruikt, maar het relatief goedkope cokes (koolstof).
Metalen en op vergelijkbare manier ook de niet-metalen, kunnen dus via reductiereacties vrijgemaakt worden uit zouten en uit gesteenten. Met metalen is iets bijzonders aan de hand. Zij behoren tot eenzelfde groep stoffen omdat zij allemaal een spiegelende werking hebben en elektriciteit geleiden.
Edele metalen
Metalen verschillen echter in edelheid. Bekend is het edele metaal goud. Goud verliest vrijwel nooit zijn metaaltoestand. Het kan niet roesten of verbranden. Alleen het zeer agressieve koningswater, een mengsel van salpeterzuur en zoutzuur, kan het koninklijke metaal oplossen.
Onedele metalen
Aan de andere kant van het spectrum staan de zeer onedele metalen. Natrium en kalium zijn zo onedel dat zij binnen seconden reageren met lucht en met water. Vandaar dat zij altijd ondergedompeld zijn in olie om ze te bewaren.
Koper konden we vrijmaken uit kopersulfaat. Met natrium lukt dat niet. Om natrium als metaal vrij te maken hebben we elektriciteit nodig. We smelten keukenzout (natriumchloride) zodat het vloeibaar wordt. Dan steken we twee electroden in de gesmolten vloeistof en zetten er spanning op. Aan de min-pool onstaat het natrium, aan de plus-pool het chloorgas.
Niet-metale
We hebben een aantal metalen leren kennen. Wanneer een element niet tot de metalen behoort spreken we van niet-metalen. Belangrijke voorbeelden van niet-metalen zijn zwavel (S), fosfor (P) en koolstof (C). Uit deze stoffen vormen zich zuren: koolzuur H2CO3, zwavelzuur H2SO4, salpeterzuur HNO3.
Proef 7 verbranden van zwavel.
Zwavel is een niet-metaal met een helder gele kleur. Het is een isolator. Het zwavel wordt in een reageerbuis gedaan en wordt met behulp van een vlam verwarmd. Het gele poeder wordt helder en dun vloeibaar. Eerst geel, maar al gauw oranje, rood, roodbruin.
Als we de buis omkeren blijkt dat de vloeistof zo stroperig geworden is dat hij niet meer stroomt. Bij verder verhitten wordt de stof weer vloeibaar en diep donker rood, bijna zwart. Boven in de reageerbuis condenseert geel zwavel. We gaan zover door tot dat de zwavel kookt. Als we de kokende vloeistof in water gieten vliegt het zwavel spontaan in brand. We zien aan de druppels zwavel blauwe vlammen ‘hangen”. De verbrandingsgassen prikkelen de keel en kleuren indicatorpapier rood.
Conclusie
Zwavel smelt bij 119°C. Bij hogere temperaturen neemt de viscositeit enorm toe omdat zwavel met zichzelf reageert. Zwavel kookt onder atmosferische druk bij 445°C. Bij afschrikken in koud water van de smelt vormt zich plastische zwavel.
Bij de verbranding reageert zwavel met zuurstof en vormt zwaveloxide en komt veel warmte vrij. Wanneer dit gas in water wordt geleid reageert dit gas met water en vormt zwavelzuur. Bij deze stap komt weer warmte vrij. Wanneer geconcentreerd zwavelzuur met water verdund wordt komt weer veel warmte vrij. Geen wonder dus dat zwavel vroeger sulfur (sulforisch = zonnedrager) genoemd werd.
zwavel + zuurstof -> zwaveloxide (+ warmte)
geel, vast prikkelend gas
zwaveloxide + water -> zwavelzuur, vloeistof (+ warmte)
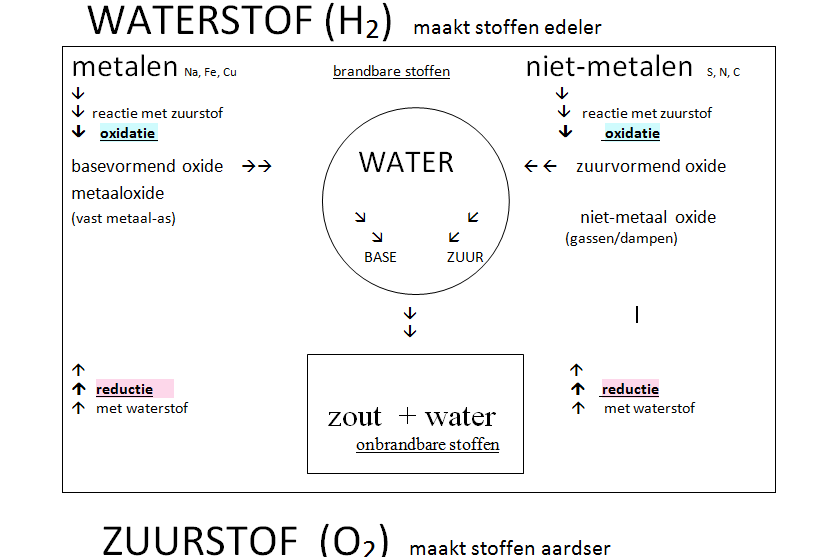
Overzicht zouten, zuren en basen
Uit voorgaande proeven zien we dat de basen uit metalen ontstaan en de zuren uit niet-metalen. Grofweg klopt dit beeld. Een belangrijke uitzondering die we meteen moeten noemen is ammonia NH4OH, deze stof is een base maar het bestaat volledig uit niet-metalen.
Waterstof en zuurstof zijn twee zeer polaire stoffen. Waterstof is extreem fijn en brandbaar. Het komt in grote hoeveelheden voor in de kosmos. Het is deel van de zonnewind en de aarde ontvangt van hieruit steeds verse waterstof.
Zuurstof is zeer aards en “trekt” de stoffen in de aardse toestand. Zuurstof doet waterstof branden. Bij deze reactie ontstaat water.
zuurstof + waterstof -> water (cirkel in het schema)
Zuivere metalen en niet-metalen staan boven in het schema, omdat zij brandbaar zijn. Je zou kunnen zeggen dat zij uit een oertijd stammen waar de stoffen nog niet geoxideerd waren. Wanneer zij verbranden met zuurstof worden de stoffen ‘omlaag’ getrokken in de oxide toestand. De oxiden kunnen met behulp van waterstof worden ’opgetild’.
De reactie met zuurstof heet OXIDATIE.
Voorbeeld: natrium + zuurstof -> natriumoxide (vast, basevormer)
Het natriumoxide kunnen we daarna laten reageren met water.
natriumoxide + water -> natronloog oplossing, gootsteenontstopper
Aan de rechterkant, de kant van de niet-metalen kunnen we als voorbeeld de reactie nemen van zwavel (S).
Voorbeeld: zwavel + zuurstof -> zwaveloxidegas
Het zwaveloxide kunnen we daarna laten reageren met water.
zwaveloxidegas + water -> zwavelzuur
Tot slot kunnen we het natronloog laten reageren met het zwavelzuur (neutralisatiereactie). zwavelzuur + natronloog -> water + natriumsulfaat (zout)
De oerstoffen, de zuivere elementen, die veel energie bevatten zijn via oxidatie hun energie kwijtgeraakt en zijn uiteindelijk tot rust gekomen in de stenen (aardkorst) en het water (de zee).